Ми закінчили тему " Періодичний закон та Періодична система".
Сьогодні починаємо заключну тему 8 класу " Хімічний зв'язок"
Чому утворюється хімічний звязок?
Ми вже знаємо, що кільксть електронів на зовнішньому рівнян у елементів визначається за номером групи. У металів на зовнішньому рівня від 1 до 3 електронів , у неметалів 4 і більше. так от , усі хімічні елементи, крім інертних намагаються при утворені хімічного звязку завершити свої зовнішні енергетичні рівні до 8 електронів. Вони або уворюють спільні пари електронів або віддають та приєднують електрони.
А чому інертні не намагаються завершити свої рівні, майже не вступають у хімічну взаємодію?
Так от , в залежності від механізму утворення звязку , розрізніють такі його 4 види.
(Запишіть табличку)

Оце все перепишіть у зошит.
Ковалентний звязок - це звязок, що утворюється між атомами неметалів за рахунок спільних електронних пар.
Як ви бачите з таблички, існують 2 види ковалентного звязку- неполярний та полярний.
Неполярний утворений однаковими неметалами або ,як кажуть , неметалами з однаковою електронегативністю.Cl2, H2, N2, O2, Br2
Ковалентний полярний утворюється між різними неметалами або між неметалами з різною електронегативністю. НCl, NH3, H2S, CH4, H2SO4, H2O ...
Йонний зв'язок , як правило, утворюється між атомами металів та неметалів:
NaCl, CaO, Mg Br2, KI, FeS, BaSO4
Отже , підсумуємо. Основні 2 типи звязки це - ковалентний та йонний.
Ковалентного звязку є 2 види - неполярний та полярний.
Наприклад , елемент Хлор може утворювати такі типи зв'язку:
( однакові неметали) ( різні неметали) ( метал + неметал)
Як же утворюється ковалентний звязок?
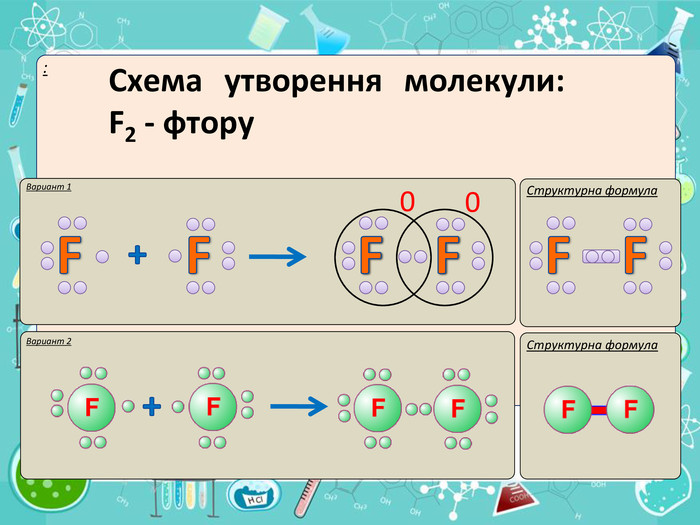
Номер групи вказує кількість електронів на зовнішньому рівні. наприклад, у Флуору у 7 групі на зовнішньому рівні 7 електронів. До завершення ( до 8) не вичстачає 1 електрона. Отже, кожен атом Флуору виділяє одне одному по 1 електрону на утворення спільної пари.
Електрони малюємо крапочками. І тільки електрони завнийшнього рівня.
Подібно і у молекулі водню. H2
У молекулі хлороводню HCl ковалентний полярний звязок.
У Гідрогена 1 електрон і йому ще не вистачає 1 електрону , у Хлору 7 електронів, але не вистачає до 8 також 1 електрон. Атоми дають одне одному по 1 електрону та утворюють спільну пару.
ЗАВДАННЯ:
1) Вивчіть визначення- що таке ковалентний звязок, що таке неполярнй та полярний ковалентний звязок та йонний ( 4 визначення)
2) розподіліть на 3 стовпчики речовини : ковалентний неполярний, ковалентний полярний та йонний. O2 , NH3, ВaO, H 2S , FeS, Br2 , N2 , KI, BaSO4 , CH4
3) дати відповідь на питання на початку пояснення.
Сьогодні починаємо заключну тему 8 класу " Хімічний зв'язок"
Чому утворюється хімічний звязок?
Ми вже знаємо, що кільксть електронів на зовнішньому рівнян у елементів визначається за номером групи. У металів на зовнішньому рівня від 1 до 3 електронів , у неметалів 4 і більше. так от , усі хімічні елементи, крім інертних намагаються при утворені хімічного звязку завершити свої зовнішні енергетичні рівні до 8 електронів. Вони або уворюють спільні пари електронів або віддають та приєднують електрони.
А чому інертні не намагаються завершити свої рівні, майже не вступають у хімічну взаємодію?
Так от , в залежності від механізму утворення звязку , розрізніють такі його 4 види.
(Запишіть табличку)
Оце все перепишіть у зошит.
Ковалентний звязок - це звязок, що утворюється між атомами неметалів за рахунок спільних електронних пар.
Як ви бачите з таблички, існують 2 види ковалентного звязку- неполярний та полярний.
Неполярний утворений однаковими неметалами або ,як кажуть , неметалами з однаковою електронегативністю.Cl2, H2, N2, O2, Br2
Ковалентний полярний утворюється між різними неметалами або між неметалами з різною електронегативністю. НCl, NH3, H2S, CH4, H2SO4, H2O ...
Йонний зв'язок , як правило, утворюється між атомами металів та неметалів:
NaCl, CaO, Mg Br2, KI, FeS, BaSO4
Отже , підсумуємо. Основні 2 типи звязки це - ковалентний та йонний.
Ковалентного звязку є 2 види - неполярний та полярний.
Наприклад , елемент Хлор може утворювати такі типи зв'язку:
Cl2 HCl NaCl
ковалентний НЕПОЛЯРНИЙ ковалентний ПОЛЯРНИЙ ЙОННИЙ( однакові неметали) ( різні неметали) ( метал + неметал)
Як же утворюється ковалентний звязок?
Номер групи вказує кількість електронів на зовнішньому рівні. наприклад, у Флуору у 7 групі на зовнішньому рівні 7 електронів. До завершення ( до 8) не вичстачає 1 електрона. Отже, кожен атом Флуору виділяє одне одному по 1 електрону на утворення спільної пари.
Електрони малюємо крапочками. І тільки електрони завнийшнього рівня.

Подібно і у молекулі водню. H2
H • • Н H (• •
) H H ─ H
Електронна формула
Структурна формула
У молекулі хлороводню HCl ковалентний полярний звязок.
У Гідрогена 1 електрон і йому ще не вистачає 1 електрону , у Хлору 7 електронів, але не вистачає до 8 також 1 електрон. Атоми дають одне одному по 1 електрону та утворюють спільну пару.
• • • • δ+ δ-
->H • • Cl :
H (• • ) Cl
: H Cl
Але у молекулі водню спільна пара не зміщена до жодного атома, тому що у атомів однакова електронегативність , тобто по силі вони однакові. У молекулі HCl , спільна пара зміщена до більш електронегативного Хлору і звязок стає полярним. Те , що він полярний вказують заряди - дельта минус та дельта плюс.
ЗАВДАННЯ:
1) Вивчіть визначення- що таке ковалентний звязок, що таке неполярнй та полярний ковалентний звязок та йонний ( 4 визначення)
2) розподіліть на 3 стовпчики речовини : ковалентний неполярний, ковалентний полярний та йонний. O2 , NH3, ВaO, H 2S , FeS, Br2 , N2 , KI, BaSO4 , CH4
3) дати відповідь на питання на початку пояснення.
Комментариев нет:
Отправить комментарий